气体动理论
热运动的描述 理想气体模型和物态方程
状态参量
- 体积V
- 压强p
- 温度T
热力学温标(T:K)与摄氏温标(t:℃):t = T + 273.15
平衡态 准静态过程
- 平衡态:在不受外界影响的条件下,无论初始状态如何,系统的宏观性质在经充分长时间后不在发生变化的状态
- 一定质量的气体的平衡态可以使用一组状态参量表示(p、V、T)
- 准静态过程:当气体的外界条件改变时,气体中一个状态不断地变化到另一状态,如果状态变化过程进展的十分缓慢,使所经历的一系列中间状态,都无限接近平衡状态,这个过程叫做准静态过程
理想气体物态方程
理想气体:在任何情况下都严格遵守玻意耳定律、盖吕萨克定律以及查理定律的气体 - 当质量为m、摩尔质量为M的理想气体处于平衡态时,其状态参量满足方程(理想气体物态方程): \(\(pV=\frac{m}{M}RT\)\) - 普适气体常量:\(R=8.31 J·mol^{-1}·K^{-1}\)
分子热运动和统计规律
分子热运动的图像
- 分子热运动:大量分子做永不停息的无规则运动
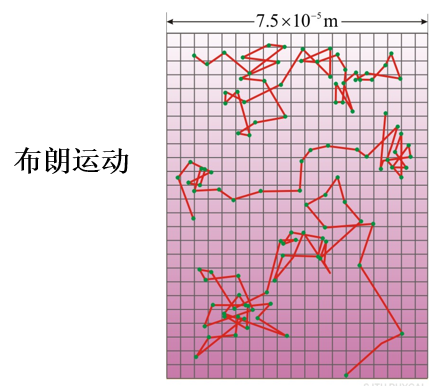
分子热运动的基本特征
- 分子永恒运动与频繁的相互碰撞
- 分布:正态分布
理想气体的压强和温度公式
理想气体的微观模型
- 力学假设:
- 将分子视作质点
- 除碰撞外,忽略其他的相互作用
- 气体分子在运动中遵守经典力学规律
- 忽略分子的重力
- 理想气体分子是自由地无规则地运动者的弹性质点群
- 统计假设:
- 平衡态时,气体分子数密度n平均分布
- 平衡态时,相同速率地分子沿各个方向运动地平均分子数相等
理想气体压强公式的推导
-
大物公式 理想气体的压强:\(p=\frac{1}{3}nm_0\bar{v^2}\)
-
大物公式 分子的平均平动动能:\(\bar{\varepsilon_k}=\frac{1}{2}m\bar{v^2}\)
-
大物公式 理想气体的压强:\(p=\frac{1}{3}nm_0\bar{v^2}=\frac{2}{3}n(\frac{1}{2}m_0\bar{v^2})=\frac{2}{3}n\bar{\varepsilon_k}\)
温度的本质和统计意义
-
大物公式 理想气体物态方程:\(pV=\frac{m}{M}RT=\frac{Nm_0}{N_Am_0}·RT=nkT\)(玻尔兹曼常量:\(k=\frac{R}{N_A}=1.38\times10^{-23}J·K^{-1}\))
-
大物公式 \(\bar{\varepsilon_k}=\frac{1}{2}m\bar{v^2}=\frac{3}{2}kT\)
- 温度的统计意义:温度标志着物体内部分子热运动的剧烈程度,是大量分子热运动的平均动能的统计平均值的度量
对于单个分子,说其有温度是没有意义的
- 温度的统计意义:温度标志着物体内部分子热运动的剧烈程度,是大量分子热运动的平均动能的统计平均值的度量
气体分子的方均根速率
-
大物公式 方均根速率:\(\frac{1}{2}m\bar{v^2}=\frac{3}{2}kT\rightarrow\sqrt{\bar{v^2}}=\sqrt{\frac{3kT}{m_0}}=\sqrt{\frac{3RT}{M}}\)
能量均分定理 理想气体的内能
分子的自由度
- 自由度:决定某物体在空间的位置所需要的独立坐标数目
- 刚性气体分子的自由度
- 单原子分子:
- He、Ar
- 三个自由度
- 双原子分子:
- H₂、O₂、N₂
- 五个自由度
- 多原子分子:
- H₂O、CH₄
- 六个自由度
- 单原子分子:
能量均分定理
-
大物公式 每个平动自由度都具有相同的平均动能:\(\frac{kT}{2}\)
- 分子的平均动能:\(\bar{\varepsilon}=\frac{i}{2}kT\)
- 单原子分子:\(\bar{\varepsilon}=\frac{3}{2}kT\)
- 双原子分子:\(\bar{\varepsilon}=\frac{5}{2}kT\)
- 多原子分子:\(\bar{\varepsilon}=\frac{6}{2}kT\)
理想气体的内能
- 气体的内能:气体中所有分子的热运动动能和分子间相互作用势能的总和
- 理想气体内能:气体中所有分子的平均动能的总和
-
大物公式 质量为m,摩尔质量为M的理想气体内能:\(E=\frac{m}{M}E_0=\frac{m}{M}\frac{i}{2}RT\)
一定量的理想气体,其内能只是温度的单值函数
麦克斯韦速率分布率
速率分布函数
- 概率密度:\(f(v)=\frac{1}{N}\frac{dN}{dv}\)
- 物理意义:分子速率位与v附近单位速率区间内的分子数占总分子数的百分比
- 分子速率位于\(v\sim v+dv\)区间内的分子数占总分字数的百分比:\(f(v)dv=\frac{dN}{N}\)
- 分子速率位于\(v_1\sim v_2\)之间的数量为:\(\Delta N = N\int^{v_2}_{v_1}f(v)dv\)
\(\int^{\infty}_{0}f(v)dv=1\)
麦克斯韦速率分布律
- 平衡状态中气体分子速率分布函数:\(f(v)=4 \pi\left(\frac{m_{0}}{2 \pi k T}\right)^{3 / 2} \mathrm{e}^{-\frac{m_{0} v^{2}}{2 k T}} v^{2}\)
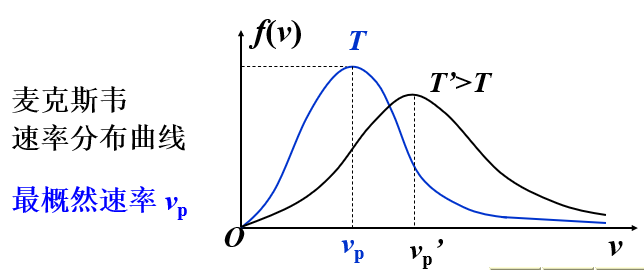
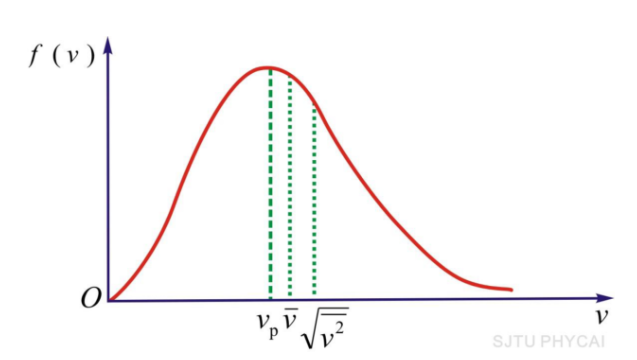
- 平衡态下三个分子速率的统计平均值
- 平均速率:\(\bar v = \int^{\infty}_{0}vf(v)dv\)
- 方均根速率:\(\frac{1}{2}m\bar{v^2}=\frac{3}{2}kT\rightarrow\sqrt{\bar{v^2}}=\sqrt{\frac{3kT}{m_0}}\approx1.71\sqrt{\frac{RT}{M}}=\sqrt{\int^{\infty}_{0}v^2f(v)dv}\)
- 最概然速率:\(v_p=\sqrt{\frac{2kT}{m_0}}\approx1.41\sqrt{\frac{RT}{M}}\)
分子碰撞和平均自由程
- 平均碰撞频率\(\bar Z\):1s内一个分子和其他分子碰撞的平均次数
- \(\bar Z = \sqrt 2 \pi d^2 \bar v n\)
- 平均自由程\(\bar \lambda\):没两次连续碰撞间一个分子自由运动的平均路程
- \(\bar \lambda=\frac{\bar v}{\bar Z}=\frac{1}{\sqrt2\pi d^2n}\)